Recentemente participei de um "debate" (percebam-se as aspas) com o Dr. Eberlin, notório defensor do design inteligente no Brasil, que propõe que a homoquiralidade da moléculas bioquímicas é uma prova da ação de uma inteligência na história da vida.
 |
| Moléculas quirais - NASA |
As questões propostas e as respostas podem ser vistas no prolífico site Evolution Academy.
A HOMOQUIRALIDADE – “OURO DOS TOLOS” E O ÔNUS DA PROVA
{PARTE 1} RESPOSTAS A MARCOS EBERLIN
{PARTE 2} RESPOSTAS A MARCOS EBERLIN
{PARTE 3} RESPOSTAS A MARCOS EBERLIN
{PARTE 4} RESPOSTAS A MARCOS EBERLIN
{PARTE 5} RESPOSTAS A MARCOS EBERLIN
{PARTE 6} RESPOSTAS A MARCOS EBERLIN
{PARTE 7} RESPOSTAS A MARCOS EBERLIN
{PARTE 8} RESPOSTAS A MARCOS EBERLIN
{PARTE 9} RESPOSTAS A MARCOS EBERLIN
{PARTE 10} RESPOSTAS A MARCOS EBERLIN
Aqui, publicaremos por hora um texto contendo a explicação de por qual motivo uma questão dele contém um erro em Química Orgânica e um texto recente sobre homoquiralidade das moléculas bioquímicas, uma hipótese sobre o mecanismo de sua origem em meio abiótico (sem vida) e uma relação deste fenômeno da geometria das moléculas bioquímicas com a hipótese do "mundo de RNA".
Por fim, acrescentaremos a recém formalizada falácia sobre o tema.
Hidrólise de aminoácidos ramificados
Algumas considerações sobre a estabilidade dos monômeros dos peptídeos
Algumas considerações sobre a estabilidade dos monômeros dos peptídeos
Devemos separar completamente a hidrólise de aminoácidos ramificados do que seja a hidrólise de um a ligação peptídica, ligação esta que é a formação de um grupo amida.[1]
Uma rápida consulta mesmo numa fonte trivial como a Wikipedia em inglês já permite entender do que tratamos, em especial para os não acostumados com a Química.
“Ligações amida constituem uma característica que define as moléculas de proteínas, a estrutura secundária das quais é devida, em parte, às capacidades das ligaçções de hidrogênio das amidas. Ligações amida em um contexto bioquímico são chamadas de ligações peptídicas quando ocorrem na cadeia principal de uma proteína e ligações isopéptideas quando elas ocorrem em uma cadeia lateral da proteína.”[2]
Da mesma fonte trivial, vamos destacar especialmente:
“A ligação amida é formada facilmente, confere rigidez estrutural, e resiste à hidrólise.”[2]
Também na trivial Wikipedia:
“Os ácidos minerais fortes podem prontamente hidrolisar as ligações peptídicas em proteínas. No entanto, algumas proteínas são extremamente resistentes à hidrólise. Um exemplo bem conhecido é a ribonuclease A, e um método para a sua purificação envolve o tratamento de extractos em bruto com ácido sulfúrico quente de modo a que outras proteínas tornam-se degradado enquanto a ribonuclease A é deixada intacta.”[3]
E some-se a referência confiável como o Protein Data Bank.[4]
Assim, as polimerizações de aminoácidos não são facilmente hidrolisadas, e tecidos formados de colágeno são bastante resistente à soluções ácidas e alcalinas, e só são degradados realmente quando condições cáusticas entram em ação. Proteínas como a queratina inclusive permitem alta resistência à água somando este fator, e contando com formação de “pontes” de radicais altamente reativos, como os dissulfetos gerando um significativo problema em sua degradação para os mais agressivos organismos decompositores, e o ambiente marinho na história da vida sempre foi o mais propício a sobrevivência de seres vivos com alto teor de água, e frágeis paredes constitutivas, como os cnidários.[5][6]
Poupemo-nos de falar nos microorganismos extremófilos, capazes de viver nos mais variados ambientes altamente reativos.
Mesmo entre animais mais complexos encontramos espécies aptas ao meio agressivo, como a Poecilia sulphuraria, e meios com sulfetos são seguidamente associados com meios sulfurosos, e disto, ácidos.[7][8]
Então, dado que temos de aqui tratar da degradação por hidrólise apresentada, vejamos quais sõ os aminoácidos que apresentam ramificação.
Uma rápida consulta nos leva a leucina, a isoleucina e a valina. Apresentaremos suas estruturas abaixo comparativamente, para que evidenciemos seu “ramo” que representa o que seja o aminoácido, e coloquemos na mesma direção suas ramificações.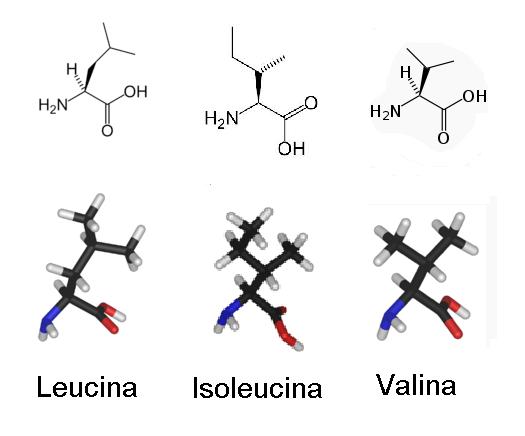
Então, dado que temos de aqui tratar da degradação por hidrólise apresentada, vejamos quais sõ os aminoácidos que apresentam ramificação.
Uma rápida consulta nos leva a leucina, a isoleucina e a valina. Apresentaremos suas estruturas abaixo comparativamente, para que evidenciemos seu “ramo” que representa o que seja o aminoácido, e coloquemos na mesma direção suas ramificações.
Percebamos que a estrutura de aminoácido é a mesma*, e a ramificação é um hidrocarboneto, digamos, “puro”. Para a leucina uma estrutura “terc-butanoica”, para a isoleucina “2-butanoica” e para a valina “2-propanoica”.
*Origem de síntese comum?
Agora, citemos uma coisa clássica:
“Algumas classes de poluentes que são geralmente resistentes à hidrólise, tal como alcanos.”[9]
Se estas estruturas são simplesmente estruturas apolares, alquídicas, alcanos, como pode-se afirmar para elas hidrólises?
Então, a hidrólise não é processo que ocorra corriqueiramente alterando tais aminoácidos, e sim, no máximo, quebrando a cadeia peptídica, como já apresentado em outras oportunidades por nós e ao qual acrescentamos que para obter a absorção de dipeptídeos, é realizada até por fitoplânctons.[10]
*Origem de síntese comum?
Agora, citemos uma coisa clássica:
“Algumas classes de poluentes que são geralmente resistentes à hidrólise, tal como alcanos.”[9]
Se estas estruturas são simplesmente estruturas apolares, alquídicas, alcanos, como pode-se afirmar para elas hidrólises?
Então, a hidrólise não é processo que ocorra corriqueiramente alterando tais aminoácidos, e sim, no máximo, quebrando a cadeia peptídica, como já apresentado em outras oportunidades por nós e ao qual acrescentamos que para obter a absorção de dipeptídeos, é realizada até por fitoplânctons.[10]
Referências
1. IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). XML on-line corrected version: http://goldbook.iupac.org (2006-) created by M. Nic, J. Jirat, B. Kosata; updates compiled by A. Jenkins. ISBN 0-9678550-9-8. doi:10.1351/goldbook.
4. "Ribonuclease A".- Protein Data Bank.
5. E. J. VAN SCOTT, M.D.; PETER FLESCH, M.D., Ph.D.; SULFHYDRYL GROUPS AND DISULFIDE LINKAGES IN NORMAL AND PATHOLOGICAL KERATINIZATION; AMA Arch Derm Syphilol. 1954;70(2):141-154. doi:10.1001/archderm.1954.01540200001001. http://archderm.jamanetwork.com/article.aspx?articleid=524062
6. Dr. Jiří Kunert; Biochemical mechanism of keratin degradation by the actinomycete Streptomyces fradiae and the fungus Microsporum gypseum: A comparison; Journal of Basic Microbiology, Volume 29, Issue 9, pages 597–604, 1989 - DOI: 10.1002/jobm.3620290909
7. Tobler, M., R. Riesch, F. J. Garcia de Léon, I. Schlupp & M. Plath (2008): Two endemic and endangered fishes, Poecilia sulphuraria (Alvarez, 1948) andGambusia eurystoma Miller, 1975 (Poeciliidae, Teleostei), as only survivors in a small sulphidic habitat. Journal of Fish Biology 72 (3): 523-533.http://onlinelibrary.wiley.com/doi/10.1111/j.1095-8649.2007.01716.x/abstract
8. Iliuta Alexandru; SULPHUROUS MINERAL WATERS; Balneo-Research Journal Vol.2, Nr.3, 2011.
8. Iliuta Alexandru; SULPHUROUS MINERAL WATERS; Balneo-Research Journal Vol.2, Nr.3, 2011.
9. Pedro J. Alvarez, Walter A. Illman; Bioremediation and Natural Attenuation: Process Fundamentals and Mathematical Models; John Wiley & Sons, 2005. pág. 27http://books.google.com.br/books?id=fSUtC8luIp0C&pg=PA26&lpg=PA26&dq=resistance+hydrolysis+alcanes&source=bl&ots=ySY11rV7WT&sig=fZI2blCltr1yWqppn6vye1jcIsA&hl=pt-BR&sa=X&ei=z_9uUf-BB5GG9gTRyYGwDw&ved=0CDcQ6AEwAA#v=onepage&q=resistance%20hydrolysis%20alcanes&f=false
10. Margaret R. Mulholland and Cindy Leeb; Peptide hydrolysis and the uptake of dipeptides by phytoplankton; Limnol. Oceanogr., 54(3), 2009, 856–868
Homoquiralidade, fundamentos de sua seleção mineral abiótica e relação com a hipótese do “mundo de RNA”
A origem mais remota da homoquiralidade de L-aminoácidos, é desde muito um mistério na formação das primeiras formas de vida e ainda antes na sua fase de evolução química.
Compreender a indução de quiralidade e seus processos de amplificação e a construção de superfícies globalmente homoquirais representam desafios essenciais em estudos de quiralidade de superfície. Pesquisa dos fundamentos dos processos físico-químicos minerais envolvidos
Induz-se a homoquiralidade global em redes enantiomórficas bidimensionais de moléculas aquirais via co-montagem com co-absorventes quirais.[Nota 1]
As investigações por microscopia de tunelamento com varredura e as simulações mecânicas moleculares demonstram que a quiralidade pontual dos co-absorventes transfere-se para a quiralidade organizacional das unidades do conjunto através de interações supramoleculares enantioseletivas e são amplificadas hierarquicamente na homoquiralidade global de redes bidimensionais.[Nota 2][1]
A homoquiralidade global do conjunto de rede mostra dependência não linear sobre o excesso enantiomérico de co-absorventes quirais em fase de solução, ou seja, independe da proporção dos enantiômeros, o que demonstrou, pela primeira vez, a validação das "regras" para a maioria dos controles de homoquiralidade de moléculas aquirais na interface líquido/sólido. Tal efeito de amplificação e indução de quiralidade não linear promete uma nova abordagem para o controle bidimensional da homoquiralidade e pode revelar conhecimentos importantes sobre a catálise heterogénea assimétrica, a separação quiral e a cristalização quiral.
A aminoacilação como processo seletivo quiral
O processo - conjunto de reações químicas que é a aminoacilação de tRNA pode ter provido uma seletividade quiral, uma vez que é o primeiro processo onde encontram-se aminoácidos e o RNA.[Nota 3][2]
Um RNA de dimensões menores, chamado no meio do estudo da biopoese “minihelix”, sendo o provável progenitor do tRNA moderno foi aminoacido por um fosfato oligonucleótido aminoacilo que exibiu uma clara preferência para a forma L, em oposição aos D-aminoácidos. Um sistema de RNA “de imagem espelhada” com a L-ribose exibe seletividade oposta, ou seja, apresenta uma aparente preferência para os D-aminoácidos.
A seletividade para os L-aminoácidos está baseada na estereoquímica do RNA. A cadeia lateral de D-aminoácidos está localizado mais perto do terminal de adenosina do minihelix, fazendo com que eles colidam e interferam durante a etapa de transferência de aminoácidos. Estes resultados sugerem que o mundo RNA hipotético que precedeu o cenário de proteínas determinou a homoquiralidade de L-aminoácidos através da aminoacilação de tRNA.
Um RNA de dimensões menores, chamado no meio do estudo da biopoese “minihelix”, sendo o provável progenitor do tRNA moderno foi aminoacido por um fosfato oligonucleótido aminoacilo que exibiu uma clara preferência para a forma L, em oposição aos D-aminoácidos. Um sistema de RNA “de imagem espelhada” com a L-ribose exibe seletividade oposta, ou seja, apresenta uma aparente preferência para os D-aminoácidos.
A seletividade para os L-aminoácidos está baseada na estereoquímica do RNA. A cadeia lateral de D-aminoácidos está localizado mais perto do terminal de adenosina do minihelix, fazendo com que eles colidam e interferam durante a etapa de transferência de aminoácidos. Estes resultados sugerem que o mundo RNA hipotético que precedeu o cenário de proteínas determinou a homoquiralidade de L-aminoácidos através da aminoacilação de tRNA.
Notas
1. DR. FÚRIO DAMIANI, DR. PETER JÜRGEN TATSCH; MICROSCÓPIO DE TUNELAMENTO COM VARREDURA (STM)
1. DR. FÚRIO DAMIANI, DR. PETER JÜRGEN TATSCH; MICROSCÓPIO DE TUNELAMENTO COM VARREDURA (STM)
2. Enantiomórfico: Qualquer um de um par de cristais, moléculas ou compostos que são imagens espelhadas um do outro, mas não são idênticos e que rotacionam o plano de luz polarizada da mesma forma, mas em direções opostas. Também chamado enantiômero, em química, um isômero óptico.
3. Aminoacilação é o processo de adição de um grupo aminoacilo a um composto.
Referências
1. Koji Tamura; Origin of amino acid homochirality: Relationship with the RNA world and origin of tRNA aminoacylation; BioSystems 92 (2008) 91–98
2. Ting Chen, Wen-Hong Yang, Dong Wang & Li-Jun Wan; Globally homochiral assembly of two-dimensional molecular networks triggered by co-absorbers; Nature Communications 4, Article number: 1389 doi:10.1038/ncomms2403
Para consultar este texto no formato "Google Docs": docs.google.com - Homoquiralidade
As inocorrentes reações laterais
...e a repetição disfarçada de uma falácia já clássica
...e a repetição disfarçada de uma falácia já clássica
“Verdadeiros robôs moleculares a orquestrar com uma eficiência a formação de ligações peptídicas, evitando as reações laterais mortais à Vida, e com uma eficiência acima de 5 noves (1 erro em 1 bilhão) a em um processo frenético (várias ligações peptídicas por segundo).” - Exclusiva com Marcos Eberlin. A origem da vida. - www.origemedestino.org.br
Representação de uma enzima em ação, no caso, produzindo claramente uma síntese por adição. - www.slideboom.com
O primeiro erro
Primeiramente, vejamos da frase acima o trecho: “Verdadeiros robôs moleculares a orquestrar com uma eficiência a formação de ligações peptídicas [...]”
Claro que as moléculas enzimas são “robôs moleculares”. Evidente que os mecanismos moleculares são autônomos e executam o que sua estrutura determina*, e coordenadas pelo DNA e RNA, realizam suas tarefas, e mesmo que sem estes coordenadores, se íntegras, continuarão a realizar sua tarefa/atividade de catálise, tanto que pode-se usar enzimas puras em processos industriais com as mais diversas finalidades.
Claro que as moléculas enzimas são “robôs moleculares”. Evidente que os mecanismos moleculares são autônomos e executam o que sua estrutura determina*, e coordenadas pelo DNA e RNA, realizam suas tarefas, e mesmo que sem estes coordenadores, se íntegras, continuarão a realizar sua tarefa/atividade de catálise, tanto que pode-se usar enzimas puras em processos industriais com as mais diversas finalidades.
*Aqui, deve-se cuidar com o termo “determina”, pois veremos adiante que há instabilidades sempre relacionadas à ação das enzimas e de qualquer outra espécie bioquímica em ação no biológico ou externamente a um organismo.
Exemplo banais e de grande escala são a produção de biodiesel ou a produção de “açúcares invertidos”.[1][2][3][4][5] A produção de aminoácidos por enzimas, já com aplicações na indústria, já é uma mostra de que as estrutura peptídicas possuem a capacidade de produzir os monômeros que constituirão outras estruturas peptídicas.[6]
Até mesmo a produção de aminoácidos da quiralidade desejada podem ser obtidos pela ação das enzimas, o que por si já mostra a seletividade quiral que tais compostos apresentam.[7][8] Estes processos já apontam que a queiralidade é definida por enzimas, ainda que a quiralidade destas seja homoquiral. Muitos destes processos se dão por hidrólise enzimática, o que já descaracteriza que uma alegada hidrólise seja ou tenha sido prejudicial à formação de componentes da vida, num meio então abiótico, ou num momento posterior, nutrientes tóxicos ao meio já biótico.[9][10][11][Nota 1]
Esta capacidade de seletividade e estabilidade da atividade catalítica é a própria segurança de se produzir formas enantiomericamente puras, noutras palavras, selecionadas quiralmente, garantida pela utilização de enzimas em escala industrial.[12]
Esta capacidade de seletividade e estabilidade da atividade catalítica é a própria segurança de se produzir formas enantiomericamente puras, noutras palavras, selecionadas quiralmente, garantida pela utilização de enzimas em escala industrial.[12]
Esse processos enzimáticos, quando estão inclusos em processos biotecnólógicos, com o uso de bactérias e leveduras como seus agentes, é sempre os que estão por trás dos processos fermentativos utilizados na indústria.[13][14]
Um exemplo deste tipo de síntese com quiralidade resultante, selecionada, definida é a produção industrial de triptofano que tornou-se predominantemente biossintética visando evitar a presença de espécies químicas tóxicas,[15] e baseia-se hoje na fermentação de serina e indol usando formas selvagens ou geneticamente modificadas de bactérias tais como B. amyloliquefaciens, B. subtilis, C. glutamicum ou E. coli. Estas cepas transportam certas mutações que previnem a recaptação de aminoácidos aromáticos ou múltipla ou sobre-expressa ação dos operons relacionados à síntese do triptofano.[Nota 2]
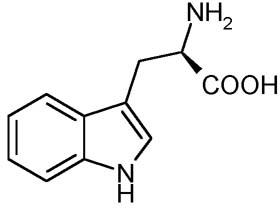
A molécula do triptofano - www.daviddarling.info.
Esta conversão - a reação obtida que leva determinadas espécies químicas a tornarem-se outras - é catalisada pela enzima triptofano-sintase.[16]
A enzima triptofano-sintase - www.bioq.unb.br.
O erro neste frase está em “eficiência”, e logo veremos o motivo.
O erro neste frase está em “eficiência”, e logo veremos o motivo.
Um segundo erro
“[...] e com uma eficiência acima de 5 noves (1 erro em 1 bilhão) a em um processo frenético (várias ligações peptídicas por segundo) [...]”
Mas percebamos que a ação das enzimas e os próprios processos biológicos não são tão exatistas em quiralidade, pois D-enantiômeros de aminoácidos tem sido detectados com técnicas cromatográficas altamente sensíveis nos próprios fluido fisiológicos humanos.[17]
A razão para tal é que as moléculas biológicas, sendo como já vimos frequentemente assimétricas em relação à sua estereoquímica, nestas características são essenciais à sua função. Por isso, posicionamentos errôneos de estruturas biomoleculares quanto à sua quiralidade podem resultar em erros de configuração, que num caso, podem gerar toxidade, útil para peçonhas, por exemplo, como se evidencia em certos moluscos, ou alta resistência ao meio, inclusive, à outras enzimas, como se vê nas paredes bacterianas.[18]
Tais alterações das atividades catalíticas seletivas de quiralidade, oriundas de mutações tem inclusive aplicações industriais.[19]
Mas neste erro percebo uma modificação da falácia de Hoyle, agora com uma peculiar “derivada em relação à variável tempo”, apresentando como miraculosa a taxa no tempo apresentada.
Obviamente, a taxa não é de todo miraculosa em tempo, pois os processos são reações químicas, e tem de pelos seus mecanismos de possuirem naturalmente tal velocidade, mas a taxa de erros apresentada, apesar de se mostrar baixa, é o suficiente para tornar em cascata todo um processo celular inviável, tóxico ou talvez até resultando no maléfico que é o cancerígeno, por exemplo, ou o simplesmente tóxico, nas enzimopatias, causadoras de diversas doenças, como anemias.[20][21][22][23]
Um terceiro erro
“[...] evitando as reações laterais mortais à Vida [...] ”
Já vimos pelo acima que os erros em reações, em quiralidade, ocorrem, e não necessariamente são maléficos, e exatamente por ocorrerem, uma falácia de Hoyle abordada por uma taxa no tempo não é de forma alguma argumento por perfeição do processo de ação das enzimas, da homoquiralidade selecionada e exatamente por isso tais processos são causadores claros de doenças.
Mas analisemos agora o termo “reação lateral”, e nos foquemos nas estruturas dos aminoácidos, e a forma com que realizam polimerização.
Uma rápida passagem de olhos por uma ilustração da Wikipédia com as estruturas dos 21 aminoácidos encontrados em eucariotas, agrupados de acordo com suas cadeias laterais, já permite perceber duas coisas:
1) Há estruturas laterais que também são aminas ou ácidos carboxílicos, de onde polimerização peptídica pode e até, dependendo da estrutura a qual o processo de polimerização chegará coordenado por enzimas polimerases deve apresentar “reações laterais”.
1) Há estruturas laterais que também são aminas ou ácidos carboxílicos, de onde polimerização peptídica pode e até, dependendo da estrutura a qual o processo de polimerização chegará coordenado por enzimas polimerases deve apresentar “reações laterais”.
2) Há estruturas laterais que não são reativas numa polimerização, o que já havia tratado, similarmente, para o caso de hidrólise nas cadeias laterais, não podendo dali resultar qualquer polimerização peptídica.
Portanto, a existência de “reações laterais” fica restrita pelo próprio tipo de reação que seja a “neutralização” acido carboxílico / amina, resultando na poliamida que é toda estrutura peptídica, e como vimos por outras vias aqui, nem sempre os erros em tais polimerizações são nocivas per se, como evidencia-se na formação de enzimas que “digerem” os subprodutos da produção de nylon, assunto de outro de nossos trabalhos.

Portanto, a existência de “reações laterais” fica restrita pelo próprio tipo de reação que seja a “neutralização” acido carboxílico / amina, resultando na poliamida que é toda estrutura peptídica, e como vimos por outras vias aqui, nem sempre os erros em tais polimerizações são nocivas per se, como evidencia-se na formação de enzimas que “digerem” os subprodutos da produção de nylon, assunto de outro de nossos trabalhos.
Os aminoácidos - Wikipedia.
Como já disse antes: “Mas meu senhor...”
Notas
1. Açúcar ou xarope de açúcar invertido é uma mistura de glicose e frutose obtida pela divisão da sacarose, o açúcar da cana) em seus dois componentes.
2. Operon é conjunto de genes nos procariontes e em alguns eucariontes que se encontram funcionalmente relacionados, contíguos e controlados coordenadamente, sendo todos expressos em apenas um RNA mensageiro
2. Ranganathan SV, Narasimhan SL, Muthukumar K.; An overview of enzymatic production of biodiesel. Bioresour Technol. 2008 Jul;99(10):3975-81. Epub 2007 Jun 25.
3. Lene Fjerbaek, Knud V. Christensen, Birgir Norddahl; A Review of the Current State of Biodiesel Production Using Enzymatic Transesterification; Biotechnology and Bioengineering, Vol. 102, No. 5, April 1, 2009
4. Nevena Luković, Zorica Knežević-Jugović and Dejan Bezbradica; Biodiesel Fuel Production by Enzymatic Transesterification of Oils: Recent Trends, Challenges and Future Perspectives - cdn.intechopen.com
6. Humg-Yo Hsiao, James F. Walter, David M Anderson and Bruce K. Hamilton; Enzymatic Production of Amino Acids - www.nottingham.ac.uk
7. S. Deepa, et al; Enzymatic production and isolation of d-amino acids from the corresponding 5-substituted hydantoins; Process Biochemistry, Volume 28, Issue 7, 1993, Pages 447–452.
8. Kimiyasu Isobe, Hiroshi Tamauchi, Ken-ichi Fuhshuku, Shouko Nagasawa, and Yasuhisa Asano; A Simple Enzymatic Method for Production of a Wide Variety of D-Amino Acids Using L-Amino Acid Oxidase from Rhodococcus sp. AIU Z-35-1; Enzyme Research, Volume 2010 (2010), Article ID 567210, 6 pages - doi:10.4061/2010/567210
9. Tan Soon Ann; PRODUCTION OF AMINO ACIDS BY THE ENZYMATIC HYDROLYSIS OF SOYA PROTEIN ISOLATE AND WHEAT GLUTEN - www.aseanfood.info
10. Wolfgang Leuchtenberger, Klaus Huthmacher, Karlheinz Drauz; Biotechnological production of amino acids and derivatives: current status and prospects; Appl Microbiol Biotechnol (2005) 69: 1–8 - DOI 10.1007/s00253-005-0155-y
11. Kamphuis J, Boesten WH, Broxterman QB, Hermes HF, van Balken JA, Meijer EM, Schoemaker HE.; New developments in the chemo-enzymatic production of amino acids.; Adv Biochem Eng Biotechnol. 1990;42:133-86.
12. Matcher GF, Dorrington RA, Burton SG.; Enzymatic production of enantiopure amino acids from mono-substituted hydantoin substrates. Methods Mol Biol. 2012;794:37-54. doi: 10.1007/978-1-61779-331-8_3.
13. Walter Carvalho, Débora D. V. Silva, Larissa Canilha e Ismael M. Mancilha; ADITIVOS ALIMENTARES PRODUZIDOS POR VIA FERMENTATIVA PARTE I: ÁCIDOS ORGÂNICOS; Revista Analytica, Agosto/Setembro 2005, Nº18. - revistaanalytica.com.br
14. Débora D. V. Silva, Walter Carvalho, Larissa Canilha e Ismael M. Mancilha; ADITIVOS ALIMENTARES PRODUZIDOS POR VIA FERMENTATIVA - PARTE 2: AMINOÁCIDOS E VITAMINAS; Revista Analytica, Outubro/Novembro 2005, Nº19. - revistaanalytica.com.br
15. John Fagan, Ph.D.; Summary of the Tryptophan Toxicity Incident - www.nemsn.org
16. Ikeda M (2002). "Amino acid production processes". Adv. Biochem. Eng. Biotechnol. Advances in Biochemical Engineering/Biotechnology 79: 1–35. doi:10.1007/3-540-45989-8_1. ISBN 978-3-540-43383-5. PMID 12523387
17. Ercal N, Luo X, Matthews RH, Armstrong DW.; In vitro study of the metabolic effects of D-amino acids. Chirality. 1996;8(1):24-9.
18. Eduard Schreiner, Leonardo G Trabuco, Peter L Freddolino and Klaus Schulten; Stereochemical errors and their implications for molecular dynamics simulations; Schreiner et al. BMC Bioinformatics 2011, 12:190. - www.biomedcentral.com
19. Chemically modified mutant serine hydrolases show improved catalytic activity and chiral selectivity - United States Patent 8357524 - www.freepatentsonline.com
20. Gregory H. Foster, Cassandra S. Armstrong, Ramesh Sakiri and Vernon L. Tesh; Shiga Toxin-Induced Tumor Necrosis Factor Alpha Expression: Requirement for Toxin Enzymatic Activity and Monocyte Protein Kinase C and Protein Tyrosine Kinases; Infect. Immun. September 2000 vol. 68 no. 9 5183-5189 - doi: 10.1128/IAI.68.9.5183-5189.2000
21. Burns, M. B., Lackey, L. et al. (2013). APOBEC3B is an enzymatic source of mutation in breast cancer Nature DOI: 10.1038/nature11881
22. Jean-Jacques Brière, Judith Favier, Anne-Paule Gimenez-Roqueplo, and Pierre Rustin; Tricarboxylic acid cycle dysfunction as a cause of human diseases and tumor formation; Am J Physiol Cell Physiol December 2006 vol. 291 no. 6 C1114-C1120.
23. Laurent R. Chiarelli, et al; Functional analysis of pyrimidine 5-nucleotidase mutants causing nonspherocytic hemolytic anemia; Blood 2005 105: 3340-3345 - doi:10.1182/blood-2004-10-3895
Para consultar este texto no formato "Google Docs": docs.google.com - As inocorrentes reações laterais
Falácia de Eberlin
De maneria similar à falácia de Hoyle [Nota 1], a falácia de Eberlin apresenta como impossível um passo de seleção de moléculas de determinada quiralidade destacadamente para os aminoácidos, monômeros das proteínas, e outras específicas para as diversas moléculas constituintes das grandes moléculas bioquímicas, como os carbohidratos e as bases nucleicas, e que “portanto”, tal seleção “tem de ser” a ação de um design inteligente
A falácia está em que desconsidera-se que as polimerizações já sejam um fator de seleção para a constituição de moléculas homoquirais, por impedimentos estéricos[Nota 2], existam evidências de mecanismos inorgânicos, minerais, de síntese seletiva em quiralidade, o que chama-se catálise assimétrica[1], que as polimerizações dos primeiros aminoácidos poderiam perfeitamente ter produzido formas enzimáticas capazes de catálise assimétrica e que posteriormente, na biopoese[Nota 3], as enzimas mantém a quiralidade sendo selecionada e perpetuada, pois as enzimas são indiscutivelmente catalisadores assimétricos.

Lembrando a falácia de Hoyle e o comentário feito sobre ela por John Maynard Smith, biólogo: “O que está errado com isto? Essencialmente, é que nenhum biólogo imagina que estruturas complexas apareçam em um único passo.”; afirmamos, similarmente: “Essencialmente, é que nenhum bioquímico envolvido com a biopoese ou com formas de vida extintas e vivas imagina que estruturas moleculares homoquirais tenham aparecido miraculosamente e contra as leis da Química na história da vida em um único passo, de um ambiente completamente enantiomérico[Nota 4] , e muito menos que hoje perpetuem-se por milagre, ainda que com suas exceções, como proteínas de venenos de moluscos e paredes de diversas bactérias”. Notas
1. Francisco Quiumento; Falácia de Hoyle - Scientia
Lembrando a falácia de Hoyle e o comentário feito sobre ela por John Maynard Smith, biólogo: “O que está errado com isto? Essencialmente, é que nenhum biólogo imagina que estruturas complexas apareçam em um único passo.”; afirmamos, similarmente: “Essencialmente, é que nenhum bioquímico envolvido com a biopoese ou com formas de vida extintas e vivas imagina que estruturas moleculares homoquirais tenham aparecido miraculosamente e contra as leis da Química na história da vida em um único passo, de um ambiente completamente enantiomérico[Nota 4] , e muito menos que hoje perpetuem-se por milagre, ainda que com suas exceções, como proteínas de venenos de moluscos e paredes de diversas bactérias”. Notas
1. Francisco Quiumento; Falácia de Hoyle - Scientia
2. Efeito estérico - Wikipédia.
3. Biopoese (do grego bio, vida, +poiéo, produzir, fazer, criar) - Teorização sobre a origem química da vida - Wikipédia.
3. Biopoese (do grego bio, vida, +poiéo, produzir, fazer, criar) - Teorização sobre a origem química da vida - Wikipédia.
4. Termo usado em Cristalografia e em moléculas na Química. Algo formado das mesmas partes dispostas em ordem inversa, de tal modo que sejam simétricas em relação a um plano.
Referências
1. Catálise assimétrica e o Prêmio Nobel de química 2001 - QNEsc
1. Catálise assimétrica e o Prêmio Nobel de química 2001 - QNEsc



